ユビキチンアルデヒド
脱ユビキチン化酵素に対して究極の感受性
76残基のアミノ酸からなるユビキチンは、真核生物に広く分布し、進化的に最も保存された蛋白質です。その主な機能は、ユビキチン / プロテアソームによる蛋白質分解システムにおいて、標的蛋白質に結合して蛋白質分解シグナルを提示する事です。すなわち、ユビキチン化酵素群によりユビキチンが標的蛋白質に結合し、それを認識したプロテアソームが標的蛋白質を分解します。その際、脱ユビキチン化酵素により、ユビキチンは遊離し再利用されます。このユビキチン化 / 脱ユビキチン化のバランスにより細胞周期、アポトーシス、シグナル伝達、転写調節、免疫応答など多彩な生命現象が制御されています。
ユビキチン化は、ユビキチンC末端のGly76のカルボキシル基と標的蛋白質の Lys のεアミノ基とのイソペプチド結合で形成されます。一方、多くの脱ユビキチン化酵素は、その結合部分のみならずユビキチン分子の全体構造を幅広く認識していると考えられています[Biochemistry, 38, 11634 (1999)]。従って、脱ユビキチン化酵素の反応において、一般的な酵素研究に用いられるアミノ酸1~4残基程度の低分子阻害剤の有効な阻害作用は認められず、ユビキチンアルデヒドの様な特異性の高い阻害剤が必要となります。
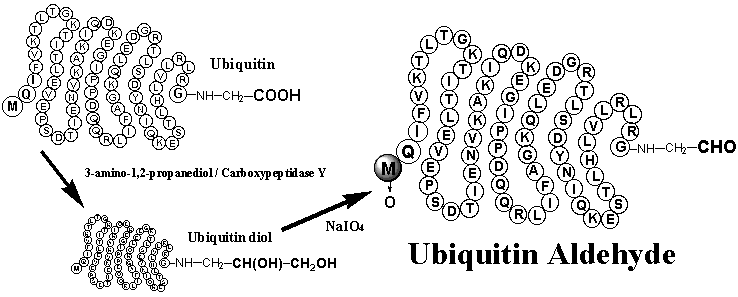
ユビキチンからユビキチンアルデヒドへの半合成経路
当社ユビキチンアルデヒドは、選択性の高い酵素法と副反応の少ない化学反応を用いて [Biochemistry, 35, 12893 (1996)]、高純度の天然ユビキチンから半合成しています。すなわち、カルボキシぺプチダーゼYを用いて、ユビキチンと3-アミノ-1,2-プロパンジオールとのトランスぺプチデーション反応により、まずユビキチンジオールを調製します。次いで、過ヨウ素酸による酸化反応でユビキチンジオールをユビキチンアルデヒドへと誘導しています。このようにして得られたユビキチンアルデヒドの阻害活性は非常に強く、脱ユビキチン化酵素 UCH-L3 に対する Ki 値: 10-14 M 以下[Biochemistry, 37, 1868 (1998)]を示すことを確認しています。今後、多彩な生命現象に深く関わるユビキチン / プロテアソーム蛋白質分解システムを更に解明するための研究に、ユビキチンアルデヒドが大きく貢献することが期待されています。
| コード | 品名 | 容量 |
| 3207-v | Ubiquitin Aldehyde | 50 μg vial |
半合成法により調製した他の製品
| コード | 品名 | 容量 |
| 4088-s | Insulin (Human) | 0.1 mg vial |
| 4088-v | Insulin (Human) | 0.5 mg vial |

