Tri-GalNAc / ASGPRリガンド (肝細胞ターゲティング試薬) 2021/07/14
本製品はasialoglycoprotein receptor (ASGPR) リガンドであるtri-GalNAc構造に架橋用のアミン (amine) 、マレイミド (Mal) 、D-システイン (D-Cys) 、アジド (azide) や 歪み促進型アジド-アルキン付加環化 (SPAAC) 用の DBCO を導入した分子です。薬剤などの機能性分子を結合させることで、ASGPRを介した肝細胞選択的な送達が期待できます。創薬研究などにお役立てください。
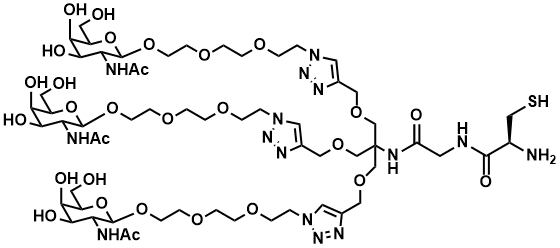
図. Tri-GalNAc-D-Cysの構造
| Code | 品名 | 容量 | 価格 |
| AP-123 | Tri-GalNAc-amine | 4 mg | 80,000 |
| AP-251 | Tri-GalNAc-Mal | 4 mg | 80,000 |
| ZY-564 | Tri-GalNAc-D-Cys | 4 mg | 80,000 |
| ZY-602 | Tri-GalNAc-azide | 4 mg | 80,000 |
| ZY-603 | Tri-GalNAc-DBCO | 4 mg | 80,000 |
ASGPRは肝細胞膜上に高発現するレセプターであり、GalやGalNAcを末端にもつ糖タンパク質が結合すると、エンドサイトーシスを介してそれらを内在化させます1)。ヒトのASGPRは、三量体を形成するためtri-GalNAc構造をもつリガンドを効率的に取り込みます2)。これまでにtri-GalNAcリガンドを用いた肝細胞指向性のRNAi治療薬やLYTACsも開発されています3)。
機能性分子との架橋部をアジドなどの官能基に変えた製品も合成可能です。
ASGPRとは
肝細胞膜上に高発現しており、アシアロ糖タンパク質 (糖タンパク質末端のシアル酸が脱シアル化し、末端がGalやGalNAcの構造になったタンパク質) を認識し、細胞内に取り込み、リソソーム内での分解へ導くことで血清中の糖タンパク質のホメオスタシスを維持する役割を担っています。アシアロ糖タンパク質はASGPRと結合するとエンドサイトーシス経由で内在化されて、エンドソーム内でASGPRから解離、リソソームへ移行されて分解されます。一方、ASGPRはリサイクルされて細胞膜表面に戻ることが知られています。
近年、ASGPRは肝細胞をターゲットとしたドラッグデリバリーのターゲットとして注目されています。これまでにASGPRリガンドにsiRNAやアンチセンスオリゴヌクレオチドを結合させて、肝細胞内選択的に送達した結果が報告されています。
またASGPRを足がかりとして、分解したい標的タンパク質を内在化させ、リソソーム内で分解する新たなケミカルバイオロジーの分解機構 (LYTACs) なども報告されています。
ASGPRリガンド
ASGPRは2つのサブユニットH1とH2からなるヘテロオリゴマーを形成しています。ヒトにおいてはH1: H2の比率が2:1のものが最も多く存在し、3つのサブユニットそれぞれが15-25Åの距離に配置されています4)。この構造に起因して、リガンドもGalやGalNAcを分子内に1個もつ構造のものより、複数の糖をもつマルチバレントなリガンドのアフィニティーが高くなることが知られています (クラスターグリコシド効果)。これまでの研究で分子内のGalあるいはGalNAcの数が4≥3>>2>>1個の順でアフィニティーが上がり、おおよそのアフィニティーは1×10-9M,5×10-9M,1x 10-6M,1x 10-3Mとなっています5)。また、糖の種類についてはGalよりGalNAcの活性が高いことが知られていることから、多くのtri-GalNAc構造をもつ合成リガンドが報告されています。
- G. Ashwell and J. Harford, Annu. Rev. Biochem., 51, 531 (1982).
- Y.C. Lee, Carbohydr.Res., 67, 509 (1978).
- A. Green, M.B. Steven, L.M. Caitlyn , M.R. Nicholas, R.C. Jennifer, and R.B. Carolyn, Nat. Chem. Biol. (2021). DOI:10.1038/s41589-021-00770-1
- R.J. Stockert, Physiol. Rev., 75, 591 (1995).
- Y.C. Lee, R.R. Townsend, M.R. Hardy, J. Lonngren, J. Arnarp, M. Haraldsson, and H. Lonn, J. Biol. Chem., 258, 199 (1983).

