- ホーム
- 受託サービス・ペプチド医薬品
- 受託ペプチド合成
- 酵素基質・阻害剤
酵素基質・阻害剤
当社は永年、酵素基質や酵素阻害剤を販売し、多くの研究者の皆様からご好評をいただいております。
近年、新規酵素の発見に伴い様々な蛍光基質、発色基質、酵素阻害剤のオーダーメイドが増加しています。種々の酵素基質、酵素阻害剤の合成経験を持つ当社が、酵素研究を実施される皆様を、『酵素基質』および『酵素阻害剤』の二点からサポートいたします。
酵素基質 (例:プロテアーゼ基質)
酵素基質
消光性蛍光基質
- 検出波長
- Nma – Dnp
- ex. 340 nm / em. 440 nm
- MOCAc (Mca) – Dnp
- ex. 328 nm / em. 393 nm
- Dabcyl – Edans
- ex. 336-340 nm / em.472-490 nm など
その他お好みの波長でデザインいたします。プロテアーゼ基質以外も合成します。
酵素阻害剤 (例:プロテアーゼ阻害剤)
- ペプチドアルデヒド (Peptide-CHO)
- ペプチドフルオロメチルケトン (Peptide-FMK、Peptide-CH2F)
- ペプチドクロロメチルケトン (Peptide-CMK、Peptide-CH2Cl)
- ペプチドボロン酸 (Peptide-B(OH)2) 一部、合成できない配列もあります。
- スタチン誘導体 、ヒドロキシメチルカルボニル誘導体
- エポキシド含有阻害剤
- ペプチド性セリンプロテアーゼ阻害剤(マリノスタチン誘導体) など
用途を踏まえてデザインもいたします。プロテアーゼ阻害剤以外も合成します。
生理作用を持つペプチドは、前駆体となるタンパクから酵素により切り出され産生されます。また、それらペプチドを分解するのも酵素です。よって、生命現象を解明するにあたり、酵素研究はとても重要です。当社は、酵素研究を実施される皆様を、『酵素基質』および『酵素阻害剤』の二点からサポートいたします。
酵素基質
酵素研究においては、通常、発色団や蛍光団をつけて分析しやすくした基質を用いて実験を行います。特に、酵素による切断前には無色もしくは無蛍光であった化合物が、酵素による切断を受けて発色もしくは蛍光を発するようになる消光性基質は、酵素研究における強力なツールです [1]。そのような消光性基質の利用は、クロマトグラフィーなどで分離することなく、系全体の吸光度もしくは蛍光測定による酵素反応の追跡を可能とします。現在までに、様々なタイプの酵素基質が知られており、なかでも、よく用いられる基質を以下に記載いたします。これらに限らず、どんなタイプの基質の合成にも挑戦いたします。もちろん、蓄積した知見と経験を踏まえ、研究者の皆様とディスカッションし、最適な基質のご提案をさせていただくことも可能です。
<よく用いられる酵素基質の構造>
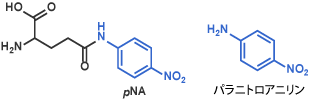
I パラニトロアニリン誘導体(発色試薬)pNAなど
パラニトロアニリド (pNA) を含む基質はほとんど無色です。一方、酵素により切り出されるパラニトロアニリンは黄色です。この変化を紫外吸光計にて検出する事が可能です [2]。同様な化合物としてパラニトロアニリンにカルボン酸を付加し、水溶性を高めた誘導体も知られています [3]。
Glu(pNA) [4] (Code 3066)
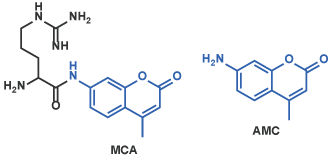
II クマリン誘導体(消光性蛍光試薬)MCA、AFCなど
アミド結合によりメチルクマリンアミド(MCA)を含有する酵素基質は蛍光を発しません。一方、酵素反応により放出されるアミノメチルクマリン(AMC)は、強い蛍光をもちます [5]。この変化を蛍光光度計などで検出します。同様な化合物として、アミノトリフルオロメチルクマリン(AFC)などが知られています [6]。
Arg-MCA [7] (Code 3113-v)
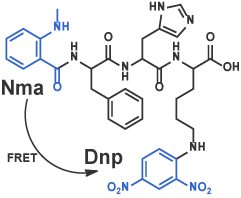
III FRETを利用した消光性蛍光基質
蛍光団からの蛍光を消光団へのフェルスター共鳴エネルギー移動 (FRET) により低減させた消光性基質は、多種多様なものが報告されています。酵素により蛍光団を含むフラグメントと消光団を含むフラグメントとに分解されると、FRETは消失し蛍光団の蛍光が回復します [8]。また、二種類の蛍光団を導入し、FRETを利用した蛍光波長のズレを検出する基質も多数報告されています。蛍光団と消光団の組み合わせは無数に存在しますが、研究者の皆様によってデザインされた消光性FRET基質を合成いたします。また、用途など踏まえて適当な組み合わせを当社からご提案させていただくことも可能です。
Nma-Phe-His-Lys(Dnp) [9] (Code 3233-v)
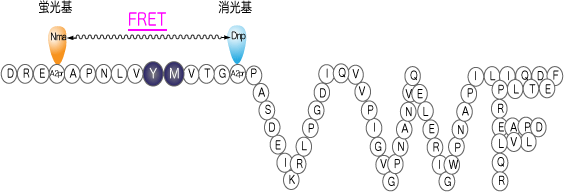
FRETS-VWF73 [10] (Code 3224-s)
B 酵素阻害剤
酵素研究において、酵素基質と共に欠かせないものは阻害剤です。酵素阻害剤の開発には長い歴史があり、日本にて発見されたロイペプチン [11] ペプスタチン [12]、キモスタチン [13] から、糖尿病治療薬として開発されたDPP IV阻害剤 [14] まで多種多様な化合物が人類社会に貢献しています。また、RNAiなどの新規手法も報告されるなか、有機化合物による酵素反応への直接の介入は依然として必要不可欠な実験とされています [15]。一般的に、そのような酵素阻害剤は天然基質を一部変更した誘導体としてデザイン、合成されます。阻害剤として、よく用いられる構造を以下に記載いたします。当社は、これらに限らず、研究者の皆様のデザインされた阻害剤の合成に挑戦いたします。また、これまでの阻害剤デザイン、合成経験を元に、研究者の皆様に最適な阻害剤のご提案させていただくことも可能です。
<酵素阻害剤の構造>
I アルデヒド
Z-Leu-Leu-Leu-H (aldehyde) [16] (Code 3175-v)
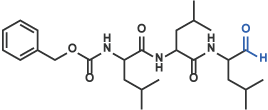
II フルオロメチルケトン(FMK)、クロロメチルケトン(CMK)、ジアゾメチルケトン類
Z-Val-Ala-Asp(OMe)-CH2F [17] (Code 3188-v)
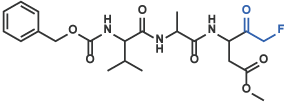
III ボロン酸
ボルテゾミブ [18]
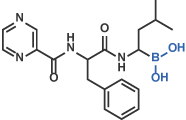
IV スタチン誘導体
Pepstatin A [12] (Code 4397)
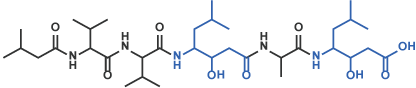
V ヒドロキシメチルカルボニル誘導体
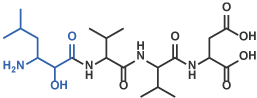
Amastatin [19] (Code 4095)
VI エポキシド
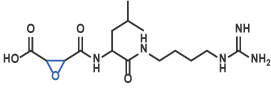
E-64 [20] (Code 4096)
VII ペプチド性セリンプロテアーゼ阻害剤(テンプレートとして合成できます)
ペプチド性セリンプロテアーゼ阻害剤(12から190残基)の中で、最小の12残基からなるマリノスタチンは、海洋細菌Pseudoalteromonas sagamiensisより産生され、特にサブチリシン(subtilisin)を強力に阻害します。構造の特徴として、Thr3-Asp9および Ser8-Asp11の側鎖間のエステル結合を有しています。
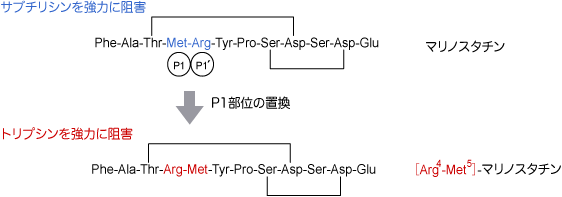
マリノスタチンの合成研究を行った結果[21]、P1位のアミノ酸をサブチリシンの認識配列であるMetから、トリプシンの認識配列であるArgに置換すると、サブチリシンに対する阻害活性は消失しました。そして、トリプシンに対して、ロイペプチンよりも強い阻害活性が新たに発現することがわかりました。マリノスタチンを構造モチーフとした新しい阻害剤の設計も可能であります。
- 寺井琢也、長野哲雄 (2011)「第1章 有機蛍光プローブ」菊地和也 編『蛍光イメージング/MRIプローブの開発』シーエムシー出版、p. 1-9。
- B.F. Erlanger, N. Kokowsky, and W. Cohen, Arch. Biochem. Biophys., 95, 271 (1961).
- J.P. Persijn, and W. van der Slik, J. Clin. Chem. Clin. Biochem., 14, 421 (1976).
- M. Orlowski, and A. Meister, Biochim. Biophys. Acta., 73, 679 (1963).
- M. Zimmerman, E. Yurewicz, and G. Patel, Anal. Biochem., 70, 258 (1976).
- R.E. Smith, E.R. Bissell, A.R. Mitchell, and K.W. Pearson, Thromb. Res., 17, 393 (1980).
- Y. Kanaoka, T. Takahashi, H. Nakayama, K. Takada, T, Kimura, and S. Sakakibara, Chem. Pharm. Bull., 25, 3126 (1977). 北海道大学と当社との共同開発品。
- S.A. Latt, D.S. Auld, and B.L. Vallee, Anal. Biochem., 50, 56 (1972).
- S. Takahashi, H. Ono, T. Gotoh, K. Yoshizawa-Kumagaye, and T. Sugiyama, Biomed. Res., 32, 407 (2011). 秋田県総合食品研究センター、秋田大学と当社の共同研究。
- K. Kokame, Y. Nobe, Y. Kokubo, A. Okayama, and T. Miyata, Br. J. Haematol., 129, 93 (2005). 国立循環器病研究センターと当社との共同開発品。「第7回産学官連携推進会議・産官学連携功労者表彰」の厚生労働大臣賞を受賞しまし た。
- S. Kondo, K. Kawamura, J. Iwanaga, M. Hamada, T. Aoyagi, K. Maeda, T. Takeuchi, and H. Umezawa, Chem. Pharm. Bull., 17, 1896 (1969).
- H. Umezawa, T. Aoyagi, H. Morishima, M. Matsuzaki, M. Hamada, and T. Takeuchi, J. Antibiot., 23, 259 (1970).
- H. Umezawa, T. Aoyagi, H. Morishima, S. Kunimoto, M. Matsuzaki, M. Hamada, and T. Takeuchi, J. Antibiot., 23, 425 (1970).
- C. F. Deacon, Diabetes, Obesity and Metabolism, 13, 7 (2011).
- (a) U. S. Eggert, C. M. Field, and T. J. Mitchison, Mol. BioSyst., 2, 93 (2006) (b) W. A Weiss, S. S Taylor, and K. M.Shokat, Nat. Chem. Biol., 3, 739 (2007).
- Y. Saito, S. Tsubuki, H. Ito, and S. Kawashima, Neurosci. Lett., 120, 1 (1990).
- H. Zhu, H.O. Fearnhead, and G.M. Cohen, FEBS Lett., 374, 303 (1995).
- J. Adams, Cancer Cell, 5, 417 (2004).
- T. Aoyagi, H. Tobe, F. Kojima, M. Hamada, T. Takeuchi, and H. Umezawa, J. Antibiotics., 31, 636 (1978).
- K. Hanada, M. Tamai, M. Yamagishi, S. Ohmura, J. Sawada, and I. Tanaka, Agric. Biol. Chem., 42, 523 (1978).
- M. Taichi, T. Yamazaki, K. Kawahara, D. Motooka, S. Nakamura, S. Harada, T. Teshima, T. Ohkubo, Y. Kobayashi, and Y. Nishiuchi, J.Pept.Sci., 16, 329 (2010). 当社研究実績。



